La biologie structurale en soutien de l'aide au diagnostic
Recherche sur le syndrome de Lynch Biologiste infos PARIS, 14 mars 2013 – Un premier modèle d’architecture de la protéine MLH1 a été mis en évidence par cristallographie aux rayons X par des chercheurs du CEA et de l’Université Paris-Sud. Il devrait permettre d’initier un projet clinique d’aide au diagnostic pour le syndrome de Lynch, […]
Recherche sur le syndrome de Lynch
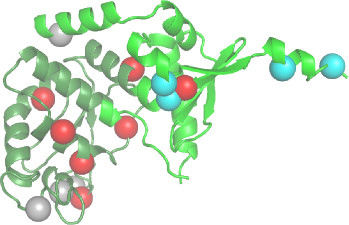
PARIS, 14 mars 2013 – Un premier modèle d’architecture de la protéine MLH1 a été mis en évidence par cristallographie aux rayons X par des chercheurs du CEA et de l’Université Paris-Sud. Il devrait permettre d’initier un projet clinique d’aide au diagnostic pour le syndrome de Lynch, une prédisposition génétique au cancer colorectal.
Le cancer colorectal héréditaire résulte essentiellement de mutations héritées situées sur trois gènes : mlh1, msh2 et msh6. Actuellement, les chercheurs déterminent par séquençage chez les patients, si les protéines transcrites à partir de ces gènes, sont tronquées ou si elles comportent des mutations ponctuelles. Ils aboutissent ainsi à une base de données caractéristique de ce syndrome, qu’ils alimentent avec les informations de chaque nouveau patient. « Au sein de la protéine MLH1, 300 mutations ponctuelles ont été détectées en différentes positions. Le séquençage linéaire permet d’identifier quels acides aminés ont été échangés avec d’autres et en quelle position. Mais l’information reste pauvre et nécessite un test fonctionnel, afin de savoir si la mutation est silencieuse ou non », précise Jean-Baptiste Charbonnier, chercheur au CEA de Saclay.
Une information structurale déterminante
Avec les données supplémentaires issues de la cristallographie et de la visualisation de la protéine à l’échelle atomique, les chercheurs ont pu identifier si les mutations se trouvaient au cœur de la protéine ou en périphérie. Au cœur de la protéine, se trouvent souvent des acides aminés hydrophobes qui interviennent dans le repliement et la configuration de la protéine. Mais tout ce qui est en surface n’est pas toujours anodin. On y trouve par exemple les sites d’interaction, les régions d’appariement entre protéines et les sites catalytiques.
« L’apport d’une information structurale unique pour chaque mutation de MLH1 permet d’ajouter une couche d’information à la base de données et d’attribuer une note de sévérité à la protéine mutée », explique le Dr Charbonnier. La structure architecturale de MLH1 était la dernière structure manquante, les protéines MSH2 et MSH6 ayant été cristallographiées par des chercheurs américains il y a un an.
« Nos informations s’ajoutent donc à celles des cliniciens et permettront d’identifier certains types de mutations de MLH1 qui déstabilisent la protéine », indique le chercheur. A l’heure actuelle, seule la moitié des mutations de MLH1 a été classée, selon que l’effet de la mutation est neutre ou délétère sur la fonction de la protéine. « Une autre moitié reste encore à classer », souligne le Dr Charbonnier. De nombreuses mutations identifiées sur MLH1 ne peuvent pas directement expliquer le syndrome. Leur implication n’est établie qu’en intégrant différents facteurs cliniques, tumoraux et familiaux. « Un patient sera mieux suivi si on sait qu’il possède une mutation qui engendre ce syndrome », ajoute le chercheur.
Une surveillance accrue de ces patients
Les chercheurs et les cliniciens travaillent déjà sur un listing de 70 mutations de MLH1 observées chez un panel de patients. Grâce aux résultats obtenus à Saclay, les chercheurs ont affiné l’impact potentiel de chaque mutation sur la voie de réparation des mésappariements de l’ADN. L’impact de ces mutations sera en effet classé en trois niveaux : haute gravité, gravité moyenne et pas de prononciation de la mutation. Ces informations assureront une prise en charge personnalisée des patients. Elles permettront une surveillance accrue de certains patients, ainsi que la résection d’une partie du côlon et la mise en place d’une chimiothérapie si nécessaire.
« Nous allons continuer à documenter ces protéines afin d’identifier les sites d’interaction qui se situent en surface, puis nous nous pencheront sur l’étude de complexes de deux, trois ou quatre protéines et sur l’effet des différentes mutations sur l’intégrité de ces complexes », assure le Dr Charbonnier. Plusieurs collaborations avec des cliniciens et avec des généticiens de la levure sont d’ores et déjà prévues, afin de mieux comprendre la sévérité de l’impact de chaque mutation dans des levures exprimant le gène mlh1 humain, ces expériences donnant une vision plus rapide des dégâts qui pourraient avoir lieu chez l’homme.
E.C.
Source : Structure of the MutLalpha C-terminal domain reveals how Mlh1 contributes to Pms1 endonuclease site. E. Gueneau et al. Nature structural & molecular biology. Publié en ligne le 24 février 2013.
Crédit photo : © CEA/CNRS/Université Paris Sud